Laboratory of Stem Cell and Regenerative Medicine
It's all possible
蠑螈肢體再生的機制
蠑螈有很強的再生能力,它的四肢、下巴、心臟、水晶體,經過部分切除後,能夠完整的再生回來。這種再生能力的細胞分子機制,目前所知仍然相當有限。我們專注在肢體再生的研究。將蠑螈肢體截斷後,約一星期就可以看到截肢末端已經長出一團芽基組織 (blastema),這個芽基類似胚胎發育時的 limb bud,由此重新發育成新的肢體。我們取二星期的芽基,經next generation sequencying的方法得到許多mRNA序列資料進行研究中。Blastema細胞是由截肢末端的成熟細胞 (如肌肉細胞、骨骼細胞、皮膚細胞、史旺細胞) 經過去分化 (dedifferentiation) 而形成的成體幹細胞。我們對於此種「去分化」的分子機制也很有興趣研究。

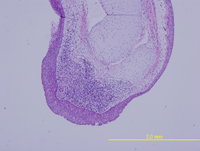
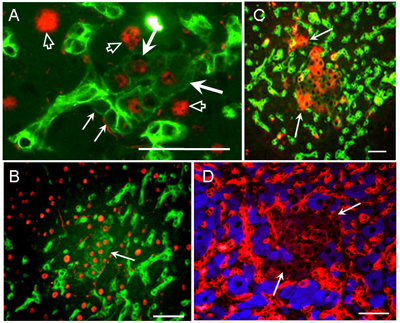
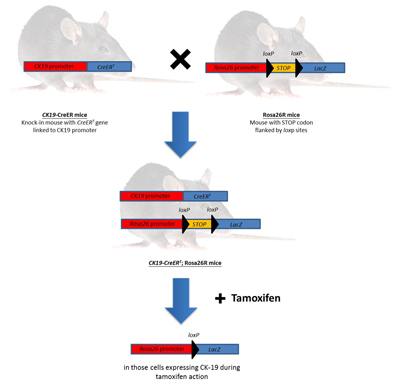
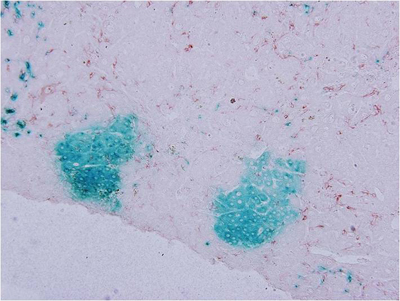
肝臟先軀細胞(progenitor cells) 在體內的分化
肝臟具有強大的再生能力。許多的研究證實肝臟受損後的修復與再生可藉由肝細胞增生或是肝臟前驅細胞分化來達成。目前我們的研究利用鼠類動物為模式探討其肝臟先驅細胞的特性與其所受到的分子調控機制。藉由化學藥劑造成小鼠肝臟的損傷以引發其肝臟先驅細胞的產生,並利用血源追蹤法 (lineage tracing) 追蹤肝臟先驅細胞的分化命運、以及探討肝癌是否由這些細胞產生。
將胚胎幹細胞及脂肪幹細胞分化為胰島細胞和肝細胞
胰島細胞移植對於糖尿病病患而言為一良好之治療模式,然而捐贈者不足以及免疫排斥卻限制了此模式的運用。胚胎幹細胞具有分化成三胚胎層的能力,提供了可行之細胞來源。我們藉由模擬胚胎發育的過程,將胚胎幹細胞逐步誘導成mesendoderm, definitive endoderm, primitive gut-tube, posterior foregut, pancreatic endoderm, insulin secreting cell。由於肝臟與胰臟在胚胎發育時期由同一芽(bud)所發育,因此我們也利用類似的模式來誘導肝細胞。此外,我們利用病毒感染脂肪幹細胞,使其表現胰島細胞特有之RNA,在合適之培養環境下,以誘導脂肪幹細胞成為類胰島細胞。
以多光子顯微鏡術觀察活體肝臟的生理、病理變化
多光子顯微鏡術 (multiphoton microscopy) 對於組織具有較強的穿透力、以及較輕微的傷害性。我們與台大物理系合作,利用此技術配合自行研發的肝臟視窗來觀察活體小鼠肝臟的代謝與病理現象。此技術可以清楚的觀察到單細胞的程度,因此可以很清晰的記錄下來普拿疼造成肝細胞壞死的過程。