我的實驗室會以基礎研究以及臨床應用雙主軸的方式規劃。基礎研究方面將以RNA甲基化在腫瘤以及發育的調控機轉為主題做實驗。臨床應用方面則是利用化學與細胞基因工程方式開發具原創性的腫瘤治療方式。研究的腫瘤類型會以乳腺癌以及B細胞淋巴癌為主。
過去研究成果
1. RNA
N6甲基化調控表皮幹細胞分化之機轉:
RNA N6甲基化現象被發現已經有50餘年,但直到近年來才因為甲基化蛋白與去甲基化蛋白的發現開始有許多重大突破。目前已經知道RNA N6甲基化在胚胎發育和腫瘤形成上都扮演重要角色。我利用RNA甲基化蛋白基因METTL14敲除之小鼠模型,搭配甲基化RNA定序(m6A-seq)發現表皮幹細胞藉由長鏈非編碼RNA(long non-coding RNA)PVT1甲基化提升其與MYC蛋白交互作用,穩定MYC結構而促使細胞分裂。MYC蛋白在細胞發育與腫瘤發生上面皆扮演重要角色。MYC雖然在多種腫瘤細胞中都有高度表達,傳統上卻被視為無法作為藥物靶向的標的。這個發現不但在了解MYC的調控機轉方面意義重大,也揭露出透過藥物調控甲基化來控制MYC蛋白的可能性。
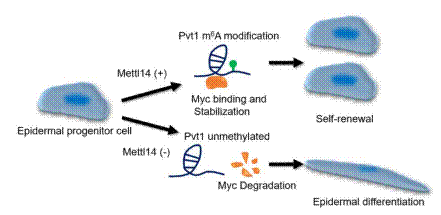
表皮幹細胞將pvt1甲基化,促進pvt1與MYC蛋白交互作用,維持MYC表達讓幹細胞持續分裂。EMBO J (2021)e106276
2. 微米載藥脈衝釋放平台於皮膚傷口復原之應用:
傷口修復的過程有多個階段,初期是發炎細胞浸潤清除微生物的發炎階段,後期則是纖維母細胞增生修補傷口的增生階段。雖然傷口修復機轉已經有相當透徹的研究,目前仍然沒有方法能有效避免傷口修補後的疤痕組織。這是因為疤痕組織是增生階段中,纖維母細胞過度活性化而產生。傳統傷口敷料雖然能夠搭載藥物,但是大多藥物在接觸傷口後立即釋放,因此只能針對初期的發炎階段做調節。針對這點,我利用能夠在固定時間以脈衝形式釋出的聚乳酸-肝醇酸(PLGA)微米膠囊載具,搭配TGF-β抑制劑作應用。微米膠囊在傷口出現約6-8天,剛好在增生階段破裂,脈衝釋出TGF-β抑制劑,抑制纖維母細胞活性進而減少疤痕組織形成,並在小鼠,紐西蘭兔,以及約克夏豬等三種動物模型得到證實。此發現重要性不單只在減少疤痕組織敷料的應用,更重要的是確立了脈衝釋放藥物平台的應用價值,未來將有可能拓展到其他臨床疾病,包括腫瘤治療方面。
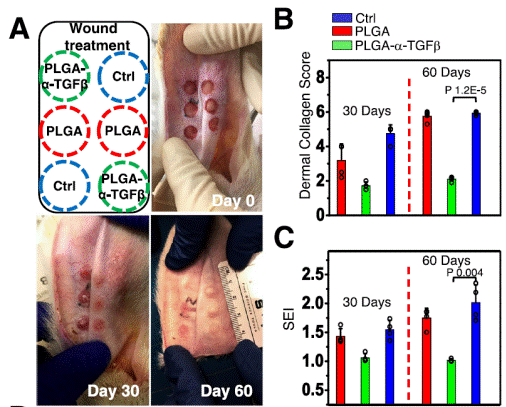
脈衝釋放膠囊用於紐西蘭兔耳疤痕模型。比較無膠囊敷料(Ctrl),膠囊敷料(PLGA),以及搭載TGF-β抑制劑膠囊(PLGA-a-TGFβ)可發現後者傷口疤痕明顯減少(Dermal Collagen Score以及SEI為兩種估算疤痕組織嚴重程度之指標)。Nat Commun .
2021 Mar 15;12(1):1670.
3. Ibrutinib在冠套淋巴癌(MCL)之抗藥機轉研究:
MCL屬於非霍金式淋巴癌(NHL)中較稀有之腫瘤(約占6%)。因為腫瘤細胞高度仰賴B細胞受器(BCR)活性,針對BCR之標靶治療也相當有效。其中Ibrutinib以BCR通路中之BTK為標靶,在慢性淋巴癌(CLL)與MCL中都有顯著的臨床療效,但是腫瘤抗藥性的問題也隨之浮現。我利用RNA定序比較具有Ibrutinib抗性以及無抗性的MCL細胞株,發現MCL抗藥細胞可能透過調節MYC啟動抗藥機轉。我們進一步發現HSP90抑制劑可以抑制MYC蛋白表達,進而消滅抗藥性MCL細胞株,也在病患腫瘤細胞老鼠活體模型(PDX)中得到佐證。此發現在MCL的臨床處置上有兩個意義,其一是未來可能使用MYC活性來預測MCL病患對Ibrutinib藥物的反應,其二則是Ibrutinib與PUH71可能可以合併使用來治療MCL。
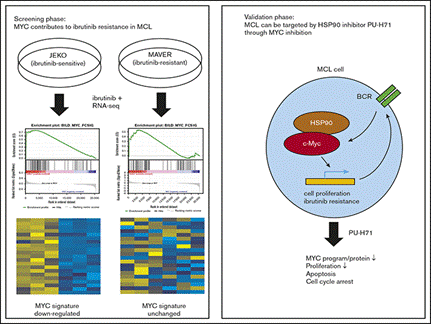
RNA定序中發現MYC活化為MCL針對Ibrutinib抗藥性之可能機轉,並利用PUH71抑制MYC通路證實。Blood Adv. 2018 Aug 28;2(16):2039-2051.